复宏汉霖(02696.HK)发布公告,近日,公司自主研发的汉贝泰 (贝伐珠单抗注射液)(“汉贝泰”)的生物制品许可申请(“BLA”)获美国食品药品管理局(“FDA”)受理,本次申请涉及的适应症包括:(1)转移性结直肠癌; (2)联合卡铂和紫杉醇一线治疗不可切除的局部晚期、复发性或转移性非鳞状非小细胞肺癌;(3)复发性成人胶质母细胞瘤;(4)联合干扰素α治疗转移性肾细胞癌;(5)上皮性卵巢癌、输卵管癌或原发性腹膜癌;及(6)联合紫杉醇和顺铂,或紫杉醇和拓扑替康治疗持续性、复发性或转移性宫颈癌。
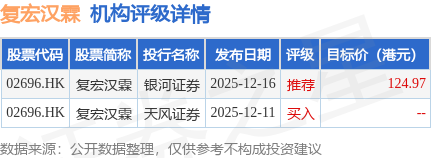
截至2026年1月13日收盘,复宏汉霖(02696.HK)报收于68.75港元,上涨6.42%,成交量102.82万股,成交额7134.31万港元。投行对该股的评级以推荐为主,近90天内共有1家投行给出推荐评级,近90天的目标均价为124.97港元。银河证券最新一份研报给予复宏汉霖推荐评级,目标价124.97港元。
机构评级详情见下表:
复宏汉霖港股市值105.57亿港元,在生物制品Ⅱ行业中排名第16。主要指标见下表:

以上内容为证券之星据公开信息整理,由AI算法生成(网信算备310104345710301240019号),不构成投资建议。
