证券之星消息,2024年11月1日微芯生物(688321)发布公告称公司于2024年10月31日进行路演,兴业证券、财通证券、国联证券、太平洋证券、长城证券、东吴证券、招商证券、永赢基金、尚信健投、东证融汇、泰康基金、国盛证券、汉康资本、华宝基金、中银国际证券、光大证券、上海盟洋投资、中银基金、碧云银霞投资、上海勤远私募基、中信证券、华夏基金、中信建投、上海禧弘私募、立本资本、德邦基金、国泰基金、上海保银投资、汇丰晋信基金、海富通基金、汇华理财、中融基金、世华资本、广发证券、金山湖投资、清松资本、东方红基金、湖南医药发展基金、涌容资产、中泰证券、长城基金、中邮基金、钜豪投资、大家资产、华西证券、北京财智聚资产、北京城天九黄、建信基金、华福证券、东北证券、海通证券、申万宏源证券参与。
具体内容如下:
问:CS231295的竞争优势和开发规划?和现有管线是否有潜在协同?
答:CS231295是公司自主研发且拥有自主知识产权的脑透过性小分子多靶点蛋白激酶抑2制剂,对于携带特定抑癌基因缺陷的肿瘤,可产生合成致死效应,并带来针对性的药效,为这类肿瘤患者提供了新的治疗选择。同时,CS231295具有显著的抗肿瘤血管生成作用,能实现广谱的抗肿瘤活性。此外,CS231295具有良好的血脑屏障透过性,对脑部原发和转移性肿瘤也存在明显的治疗优势,在恶性脑瘤及肿瘤脑转移的治疗上具备良好的应用潜力。在临床前研究中,CS231295已展现出显著的药效学活性、理想的药代动力学特征以及良好的安全性。当前CS231295的IND申请已获得CDE受理,无论是单药或与其他抗肿瘤药物联合使用,都有望为多种肿瘤提供差异化的创新治疗方案,与公司现有产品管线有很好的协同效果。
问:BD团队的建设情况以及西格列他钠、西奥罗尼海外BD的进展?
答:公司已建立拥有完整的BD团队,由鲁博亲自带队,功能覆盖对外合作方寻洽,可行性交流与评估、项目合作框架搭建、对外合作条件讨论与分析,以及各种协议条款谈判;目前已与国内外各类同行企业建立良好及有效沟通,并定期参加产业内各大国际/国内业务会议,沟通洽谈潜在合作。公司对合作开发一直持开放态度,如有相关进展,公司会及时披露。
问:西格列他钠MASH适应症的进展和计划?
答:西格列他钠治疗MSH的II期临床研究(CGZ203试验)摘要入选2024美国肝病年会口头报告,研究显示了西格列他钠针对MSH患者的肝脏脂肪蓄积、炎症、肝脏纤维化等多种病理特征综合改善的初步的积极疗效信号,同时具有良好的安全耐受性,未来在MSH治疗中具有极大的潜力。公司目前正在积极筹备MSH适应症国内的III期临床,并在寻找海外合作伙伴。
问:MASH中哪些临床指标是临床转化中比较重要的?
答:胰岛素抵抗是MSH的核心致病因素,PPR类激动剂是临床上经典的胰岛素抵抗药物。其中TZD结构的药物罗格列酮、吡格列酮曾被广泛用于糖尿病治疗,并用作MSH改善的尝试,但由于潜在安全性问题被FD黑框警告。尽管规范市场此前没有上市的MSH药物,但印度批准过PPRα/γ激动剂Saroglitazar,疗效达到了预设终点。在美国市场,PPRγ激动剂氘代吡格列酮也做过II期临床,产生了一定疗效。西格列他钠是区别于TZD结构的全新PPR泛激动剂。多个III期临床及真实世界应用都验证了其化学结构、靶向性改善带来的疗效和安全性优势。此外,在糖尿病III期临床公司也看到了其对MSH的改善趋势。目前,监管机构接受的MSH药物批准金标准终点是肝纤维化改善且MSH没有恶化,或MSH改善且肝纤维化没有恶化,并要求用肝穿检测。由于CGZ203试验是II期探索性研究,考虑患者依从性,公司在征求国内专家建议后,采用FibroScan测纤维化和MRI进行肝脏脂肪测定。这也是目前国际主流的MSH临床检测方法,一致性得到广泛认可。肝脏脂肪下降方面,目前公认指标是MRI-PDFF下降≥30%患者的比例。西格列他钠64mg剂量组在用药18周后,剔除安慰剂效应下,试验组51.6%的患者实现了≥30%下降,同类PPR全激动剂800mg剂量组在用药24周后剔除安慰剂效应仅43%患者下降≥30%。已上市THR-β药物报道数据是用药36周后剔除安慰剂效应38.2%的患者达到≥30%下降,数值尚不如西格列他钠18周效果。纤维化改善方面,FibroScan是临床用药检测的金标准。西格列他钠64mg组18周剔除安慰剂效应降低0.71kP,虽然还没有达到统计学意义,但我们认为和目前用药周期尚短、样本量过低有关,随着观察期的延长会进一步改善。THR-β的III期临床中,100mg用药523周剔除安慰剂效应LSM下降0.5kP。此外,血清LT是检测肝脏急性损伤最常用、最敏感的指标。西格列他钠用药18周后超70%患者的LT即恢复正常,而THR-β需要半年以上时间才能看到类似效果。
问:西格列他钠和海正终止推广授权后,后续的商业化策略?
答:随着公司西格列他钠片于2022年成功纳入国家医保目录以及公司自身销售团队逐步成熟,为更好地落实公司协议产品下一发展阶段的产品商业化推广策略,积极应对未来的市场竞争格局,公司拟与海正药业终止推广授权,公司收原协议约定的西格列他钠片在河南、浙江、江苏等19个省份的独家市场推广权。公司销售团队将持续以自营团队加招商代理联合进行专业化学术推广的营销模式,负责西格列他钠在中国大陆地区的全部推广活动。
微芯生物(688321)主营业务:为患者提供可承受的、临床亟需的原创新分子实体药物,具备完整的从药物作用靶点发现与确证、先导分子的发现与评价到新药临床开发、产业化、学术推广及销售的能力。
微芯生物2024年三季报显示,公司主营收入4.81亿元,同比上升38.02%;归母净利润-5108.49万元,同比下降147.26%;扣非净利润-5775.93万元,同比上升70.58%;其中2024年第三季度,公司单季度主营收入1.79亿元,同比上升67.27%;单季度归母净利润-1007.85万元,同比上升78.83%;单季度扣非净利润-1058.11万元,同比上升78.27%;负债率50.77%,投资收益-1506.09万元,财务费用1393.38万元,毛利率87.58%。
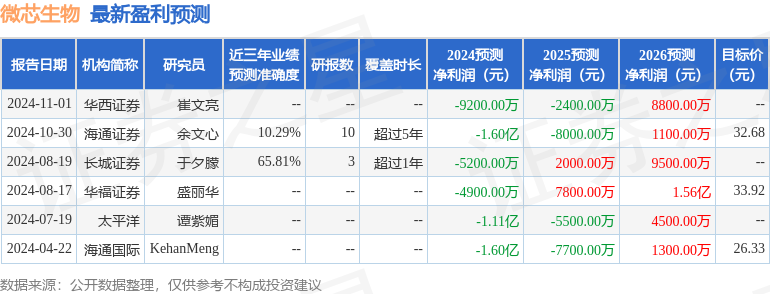
该股最近90天内共有6家机构给出评级,买入评级4家,增持评级2家;过去90天内机构目标均价为31.71。
以下是详细的盈利预测信息:
融资融券数据显示该股近3个月融资净流出1716.62万,融资余额减少;融券净流出194.65万,融券余额减少。
以上内容为证券之星据公开信息整理,由智能算法生成,不构成投资建议。










