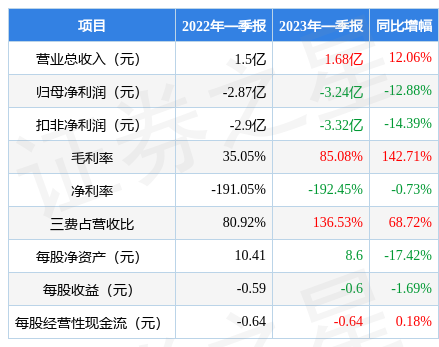
据证券之星公开数据整理,近期荣昌生物(688331)发布2023年一季报。根据财报显示,本报告期中荣昌生物增收不增利,三费占比上升明显。截至本报告期末,公司营业总收入1.68亿元,同比上升12.06%,归母净利润-3.24亿元,同比下降12.88%。按单季度数据看,第一季度营业总收入1.68亿元,同比上升12.06%,第一季度归母净利润-3.24亿元,同比下降12.88%。
本次财报公布的各项数据指标表现一般。其中,毛利率85.08%,同比增142.71%,净利率-192.45%,同比减0.73%,销售费用、管理费用、财务费用总计2.3亿元,三费占营收比136.53%,同比增68.72%,每股净资产8.6元,同比减17.42%,每股经营性现金流-0.64元,同比增0.18%,每股收益-0.6元,同比减1.69%。具体财务指标见下表:
证券之星价投圈财报分析工具显示:
从公司最新一期2022年的财务报表来看,在盈利能力方面,近期公司主营业务盈利水平差,发展压力较大,营销竞争上的投入较大。
进一步分析公司近十年以来的历史财务报表,整体来看盈利不是很稳定。盈利能力常年一般,历史财报出现过经营困难的时候。
分析公司财报数据显示:需特别注意存货数据,其存货大幅上升。公司三费占比上升明显。公司负债方面,债务压力大,近3年年均经营性现金流净额为-5.46亿元,而流动负债合计8.54亿元。
重仓荣昌生物的前十大基金见下表:
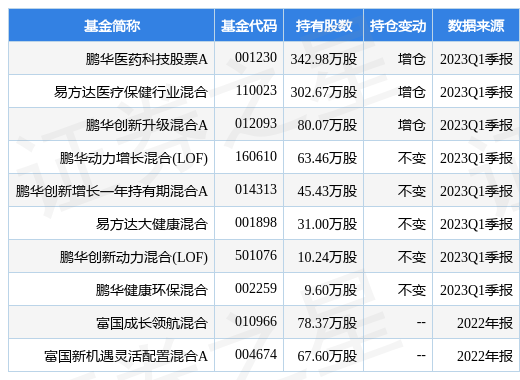
持有荣昌生物最多的基金为鹏华医药科技股票A,目前规模为31.9亿元,最新净值1.226(4月27日),较上一交易日上涨1.66%,近一年上涨34.58%。该基金现任基金经理为金笑非。
最近有知名机构关注了公司以下问题:
问:泰它西普各适应症进展情况?
答:(1)系统性红斑狼疮(SLE) 中国2021 年 3 月,泰它西普针对标准治疗反应不佳的中度至重度 SLE 获国家药品监督 管理局(NMP)有条件上市批准。基于泰它西普在中国完成的 IIb 期注册性临床试验,2019 4 年 7 月在中国启动了 SLE III 期验证性临床试验,取得了积极的临床研究结果,相关临床 研究结果亮相于 2022 年度美国风湿病学会年会(CR)上,该适应症的完全获批所需补充申 请材料已于 2022 年年底递交至 CDE。 中国2022 年 4 月,泰它西普治疗儿童活动性系统性红斑狼疮 (cSLE) 的新药临床研究 申请(IND) 获得国家药监局药品审评中心 (CDE)的临床试验默示许可。公司已在中国开展该 项临床研究。 美国美国食品药品监督管理局(FD) 于 2019 年 8 月批准泰它西普的 II 期试验性新 药(IND)申请。公司于 2020 年 1 月与 FD 举行了 II 期临床结束会议,FD 审查了我们候选药 物在中国试验中获得的积极数据及讨论了 III 期临床试验中的设计。根据本次会议,FD 允 许我们开展泰它西普用于治疗 SLE 的 III 期临床研究。2022 年,泰它西普正在全球推进该项 国际多中心的 III 期临床研究。 中国2022 年 9 月,泰它西普治疗活动性狼疮肾炎的 II 期 IND 获得国家药监局药品审 评中心 (CDE)的临床试验默示许可。 (2)免疫球蛋白 肾病(Ig 肾病) 中国公司已完成一项随机、双盲及安慰剂对照的 II 期临床试验,以评估泰它西普用 于治疗 Ig 肾病患者的疗效及安全性,并已获得积极结果。2022 年 9 月,泰它西普用于治疗 Ig 肾病的 III 期临床试验方案获得 CDE 的同意,公司已在中国开展该项临床试验研究。 美国FD 于 2020 年 12 月批准就该产品在美国进行针对 IgN 适应症进行 II 期临床试 验,计划共招募约 30 名患者,截至 2022 年 12 月 31 日,已招募 14 名患者。2022 年 11 月,FD 同意泰它西普在美国开展治疗 IgN 适应症的 III 期临床试验方案。 (3)原发性干燥综合征(pSS) 中国公司已在中国完成一项治疗原发性干燥综合征的 II 期临床试验,并已获得积极 结果。2022 年 8 月,泰它西普用于治疗 pSS 的 III 期临床方案获得 CDE 的同意,公司已在中 国开展该项临床试验研究。 美国2022 年 11 月, FD 同意泰它西普在美国开展治疗 PSS 的 III 期临床试验方案。 (4)视神经脊髓炎频谱系疾病(NMOSD) 公司正在中国开展一项随机、双盲及安慰剂对照的 III 期临床试验,以评估泰它西普治 疗 NMOSD 的疗效及安全性。公司于 2017 年 9 月启动了 III 期临床试验,截至 2022 年 12 月 31 日,已招募 149 名患者。 (5)类风湿关节炎(R) 公司正在中国开展一项多中心、双盲及安慰剂对照的 III 期临床试验。截至 2021 年年 底,公司已完成了患者招募工作。2022 年年底,公司完成了最后一例受试者的随访工作。 (6)重症肌无力(MG) 5 中国公司在中国已完成了一项随机、开放式的 II 期临床试验研究,并已取得积极结 果。2022 年 11 月,获得 CDE 纳入用于治疗全身型重症肌无力的突破性治疗药物认定,用于 治疗 MG 的 III 期临床方案已获得 CDE 的同意,公司正在中国开展该项临床试验研究。 美国2022 年 10 月,公司获得 FD 对于泰它西普用于治疗重症肌无力的孤儿药资格认 定。 (7)其他适应症 除上述适应症外,公司也在评估泰它西普用于治疗其他自身免疫性疾病,包括多发性硬 化症(MS)等多个适应症。
以上内容由证券之星根据公开信息整理,与本站立场无关。证券之星力求但不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的的准确性、完整性、有效性、及时性等,如存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。
相关新闻:
